Introducción:
El enlace covalente aparece, generalmente, en moléculas discretas (con un número determinado de átomos) y, también, se da en los llamados sólidos atómicos (o cristales covalentes).
Las dos teorías cuánticas que abordan la formación de este tipo de enlace son la Teoría del enlace de valencia (TEV) y la Teoría de orbitales moleculares (TOM). Durante este curso se estudiará principalmente el primero de ellos.
Teoría del enlace de valencia:
Según la Teoría del enlace de valencia, en la formación de enlaces entre dos átomos participan sus orbitales de la capa de valencia.
Para que se produzca un enlace, generalmente, cada átomo tiene que tener un orbital con un electrón desapareado. La compartición de electrones, propia del enlace covalente, se explica por la aproximación de las nubes de carga de los orbitales, lo que se indica diciendo que los orbitales solapan.
La fórmula molecular, en estos casos, dependerá de la covalencia o valencia covalente de los átomos que enlazan. La valencia covalente es el número de enlaces covalentes que puede formar un átomo y se relaciona con el número de electrones desapareados que el átomo tiene en su configuración fundamental o, en aquella otra, que no se diferencie mucho en energía con la fundamental.
El enlace covalente es un enlace dirigido y saturado.
Se dice que es saturado porque los elementos tienden a saturar de electrones su capa de valencia de acuerdo con lo indicado en los mecanismos A y A' propuestos por Lewis.
El enlace covalente es direccional porque no está relacionado sólo con un campo electrostático de tipo Coulomb. También puede interpretarse cualitativamente como una consecuencia de la búsqueda de una disposición geométrica de los átomos que enlazan que evite, en lo posible, las repulsiones entre los pares electrónicos enlazantes.
Molécula de H2:
En el caso del hidrógeno gaseoso, H2, según esta teoría, cuando se produzca el solapamiento de los orbitales atómicos 1s de cada hidrógeno, se producirá el enlace:

Como se observa en la figura anterior, la densidad electrónica aumenta entre los núcleos que enlazan, situándose los átomos a la distancia de equilibrio que corresponde a una menor energía. Si se representa la energía del sistema formado por los dos átomos de hidrógeno en función de la distancia de separación, se obtiene una gráfica en la que el mínimo de energía corresponde a esa distancia de enlace.
Molécula de HF:
En el caso del fluoruro de hidrógeno, el enlace se explica por el solapamiento entre el orbital 1s del hidrógeno y uno de los orbitales 2p del flúor, evidentemente con el orbital 2p que tenga el electrón desapareado.

Enlaces sigma (s) y pi (p):
El solapamiento entre dos orbitales se puede producir de dos formas distintas:
- Por solapamiento frontal. Es decir, sobre la línea de unión imaginaria que une los núcleos. Se dice que se produce un enlace de tipo sigma.
- Por solapamiento lateral. En este caso, hay dos zonas de solapamiento, una a cada lado de la línea de unión de los núcleos atómicos. Cuando esto ocurre, se dice que el enlace es de tipo pi.

El enlace de tipo pi se da cuando se tiene enlaces múltiples. El enlace sigma estabiliza más la molécula y se produce preferentemente al enlace pi.
Modelo de repulsión de los pares de electrones de la capa de valencia (RPECV):
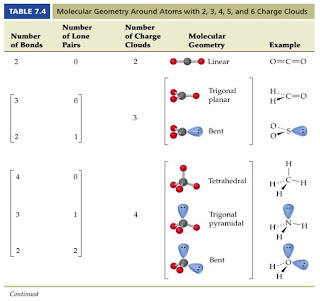
Este método nos va a ayudar, de una forma sencilla, a predecir la geometría molecular. Según éste, como entre los pares de electrones de la capa de valencia de los átomos que enlazan se producen repulsiones, cuando se forma la molécula, sus pares electrónicos se colocan lo más alejados posibles unos de otros, para que las repulsiones entre ellos sean mínimas.
Es importante tener en cuenta que a la hora de contabilizar los pares electrónicos, hay que considerar todos; es decir, tanto los de enlace, como los pares de electrones libres.
En la siguiente tabla se recoge la distribución geométrica que origina un número determinado de zonas de densidad de carga alrededor de un átomo:
| Número de zonas | Geometría electrónica | Ángulo |
| 2 | Lineal | 180º |
| 3 | Triangular plana | 120º |
| 4 | Tetraédrica | 109.5º |
| 5 | Bipirámide triangular | 120º y 90º |
| 6 | Octaédrica | 90º |
La geometría indicada en esta tabla, se refiere a la de los pares electrónicos. A la hora de considerar la geometría molecular sólo se tendrán en cuenta los pares de enlaces, pero sabiendo que los pares libres originan mayor repulsión que los de enlaces y distorsionan la disposición geométrica.
En la figura siguiente se ejemplifican las diversas geometrías moleculares que se puede obtener a partir de las geometrías electrónicas correspondientes a 2, 3 y 4 zonas de densidad
Hibridación de orbitales en la TEV:
Al deducir la geometría de los pares electrónicos de una molécula, se pueden obtener unas disposiciones que no se corresponden con la de los órbitales atómicos; es decir, si los átomos al enlazar solapan con sus orbitales s, p o d, no pueden adquirir la geometría que predice el método RPECV. La Teoría del Enlace de Valencia explica esto, aceptando que los orbitales atómicos sufren una hibridación, o combinación de algunos de ellos, previa a la formación del enlace. En el átomo se forman tantos orbitales híbridos como orbitales atómicos se mezclan.
La tabla siguiente muestra la hibridación de orbitales que se produce para alcanzar cada geometría:
| Número de zonas | Geometría electrónica | Hibridación |
| 2 | Lineal | sp |
| 3 | Triangular plana | sp2 |
| 4 | Tetraédrica | sp3 |
| 5 | Bipirámide triangular | dsp3 |
| 6 | Octaédrica | d2sp3 |
Propiedades de los compuestos con enlace covalente:
Hay que distinguir entre aquellos en los que la formación de enlaces de tipo covalente da lugar a compuestos moleculares y otros en los que se forman redes tridimensionales:
Las redes covalentes se forman por átomos que se unen entre sí por uniones covalentes, por ello la fuerza de unión es fuerte. Las propiedades de este tipo de compuesto vendrán definidas por este hecho:
- Presentan elevados puntos de fusión (generalmente subliman si se sigue calentando)
- Muy poco solubles en cualquier tipo de disolvente.
- Suelen ser duros.
- Suelen ser malos conductores de la electricidad.
Son sustancias de este tipo el diamante, SiO2 (cuarzo), carburo de silicio (Si2C), nitruro de boro (BN), etc.
Las sustancias covalentes moleculares se caracterizan porque sus átomos se unen mediante enlaces covalentes, pero forman entidades moleculares individuales. Éstas interaccionan entre sí mediante fuerzas intermoleculares, siendo el tipo de fuerza intermolecular presente la responsable de las propiedades que presentan las sustancias:
Ø Se pueden presentar en estado sólido, líquido o gaseoso a temperatura ambiente. En general, sus puntos de fusión y ebullición no son elevados, aunque serán mayores cuando las fuerza intermolecular que une a las moléculas sea más intensa.
Ø Suelen ser blandas y elásticas, pues al rayarlas sólo se rompen las fuerzas intermoleculares.
Ø La solubilidad es variable, siendo solubles en disolventes de polaridad similar. Los compuestos polares se disuelven en disolventes polares, los apolares en los disolventes apolares.
Ø En general, son malos conductores de la electricidad. Aunque la conductividad eléctrica se ve favorecida si aumenta la polaridad de las moléculas.
Son muchas las sustancias de este tipo: H2, Br2, H2O, NH3, compuestos orgánicos, etc.
Geometría molecular

Geometría de la molécula de agua.
Geometría molecular
La Geometría molecular o estructura molecular es la disposición tri-dimensional de los átomos que constituyen una molécula. Determina muchas de las propiedades de las moléculas, como son la reactividad, polaridad, fase, color, magnetismo, actividad biológica, etc.
Dado que el movimiento de los átomos en una molécula está determinado por la mecánica cuántica, uno debe definir el "movimiento" de una manera cuántica.
Los movimientos cuánticos (externos) de traslación y rotación cambian fuertemente la geometría molecular. (En algún grado la rotación influye en la geometría por medio de la fuerza de Coriolis y la distorsión centrífuga, pero son despreciables en la presente discusión).
Un tercer tipo de movimiento es la vibración, un movimiento interno de los átomos en una molécula. Las vibraciones moleculares son armónicas (al menos en una primera aproximación), lo que significa que los átomos oscilan en torno a su posición de equilibrio, incluso a la temperatura del cero absoluto. En el cero absoluto todos los átomos están en su estado vibracional basal y muestran movimiento mecánico cuántico de punto cero, esto es, la función de onda de un modo vibracional simple no es un pico agudo, sino un exponencial de ancho finito. A temperaturas mayores, los modos vibracionales pueden ser excitados térmicamente (en un interpretación clásica, esto se expresa al enunciar que "las moléculas vibrarán más rápido"), pero siempre oscilan alrededor de una geometría reconocible para la molécula.
Como se mencionó anteriormente, la rotación influye fuertemente sobre la geometría molecular. Pero, como movimiento mecánico cuántico, se excita a bajas temperaturas (comparada con la vibración). Desde un punto de vista clásico, puede decirse que más moléculas rotan más rápidamente a temperatura ambiente, esto es que tienen mayor velocidad angular y momentum angular. En lenguaje de mecánica cuántica: más "eigenstates" de alto momentum angular son poblados térmicamente al aumentar la temperatura. Las energías de excitación rotacionales típicas están en el orden de unos pocos cm-1.
Los resultados de muchos experimentos espectroscópicos están ensanchados porque involucran una media de varios estados rotacionales. Frecuentemente es difícil obtener las geometrías a partir de los espectros a altas temperaturas, porque el número de estados rotacionales rastreados en el experimento aumenta al incrementarse la temperatura. En consecuencia, muchas observaciones espectroscópicas sólo se puede esperar que conduzcan a geometrías moleculares confiables a temperaturas cercanas al cero absoluto.
Enlazamiento Por definición, los átomos en las moléculas suelen estar unidos unos a otros con enlaces covalentes, que involucran a enlaces simples, dobles o triples, donde un "enlace" es un par de electrones compartidos (la otra forma de unión entre átomos se denomina enlace iónico e involucra a cationes (iones positivos), y aniones (iones negativos).
La geometría molecular puede ser especificada en términos de longitud de enlace, ángulo de enlace y ángulo torsional. La longitud de enlace está definida como la distancia media entre los centros de dos átomos enlazados en una moléculada dada. Un ángulo de enlace es el ángulo formado por tres átomos enlazados consecutivamente. Para cuatro átomos unidos consecutivamente en una cadena línea, el ángulo torsional es el ángulo entre el plano formado por los tres primeros átomos y el plano formado por los tres últimos átomos.
Isómeros
Los isómeros son tipos de moléculas que comparten la misma fórmula química, pero que tienen diferentes geometrías, resultando en propiedades muy distintas:
Ø Una sustancia "pura" está compuesta de sólo un tipo de isómero de una molécula (todas tienen la misma estructura geométrica).
Ø Los isómeros estructurales tienen la misma fórmula química, pero diferente ordenamiento físico, frecuentemente formando geometrías moleculares alternas con propiedades muy diferentes. Los átomos no están enlazados (conectados) en el mismo orden.
Ø Los isómeros funcionales son una clase especial de isómeros estructurales, donde ciertos grupos de átomos exhiben un tipo especial de comportamiento, como es un éter o un alcohol.
Ø La estereoisómeros pueden tener muchas propiedades fisicoquímicas idénticas y, al mismo tiempo, actividad biológica muy diferente. Esto se debe a que poseen la quiralidad que es muy común en los sistemas vivientes. Una manifestación de esta quiralidad es su habilidad para hacer rotar la luz polarizada en direcciones diferentes.
Ø Protein folding, que concierne a la compleja geometría y diferentes isómeros que las proteínas pueden tener.
La geometría molecular se representa en una pirámide en la cual en la punta inicial hay una molécula de oxígeno con carga negativa, quedando en las otras dos puntas dos moléculas de hidrógeno con carga positiva, que son separadas por un ángulo de 104.5º; el enlace que une los hidrógenos con el oxígeno se llama enlace covalente, y también existe un enlace que une a otra pirámide idéntica a la anteriormente nombrada... llamado enlace puente hidrógeno...
Tipos de estructura molecular

Enlace covalente

Enlace covalente no polar hidrógeno y carbono: metano.
Un enlace covalente se produce por compartición de electrones entre dos átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro, en el enlace químico covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir se unen a través de sus electrones en el último orbital, el cual depende del número atómico del átomo en cuestión. Entre los dos átomos puede compartirse uno, dos o tres electrones, lo cual dará lugar a la formación de un enlace simple, doble o triple. En representación de Lewis estos enlaces pueden representarse por una pequeña línea entre los átomos.
Tipos de enlace covalente
Existen dos tipos de sustancias covalentes:
Sustancias covalentes moleculares: los enlaces covalentes forman moléculas que tienen las siguientes propiedades:
- Temperaturas de fusión y ebullición bajas.
- En condiciones normales (25 °C aprox.) pueden ser sólidos, líquidos o gaseosos
- Son blandos en estado sólido.
- Son aislantes de corriente eléctrica y calor.
- Solubilidad: las moléculas polares son solubles en disolventes polares y las apolares son solubles en disolventes apolares (semejante disuelve a semejante).
Redes: además las sustancias covalentes forman redes, semejantes a los compuestos iónicos, que tienen estas propiedades:
- Elevadas temperaturas de fusión y ebullición.
- Son sólidos
- Son sustancias muy duras (excepto el grafito).
- Son aislantes (excepto el grafito).
- Son insolubles.
- Son neocloridas
Polaridad del enlace covalente Consideremos átomos del hidrógeno, a medida que se aproximan entre sí, se van haciendo notar las fuerzas que atraen a cada electrón al núcleo del otro átomo, hasta que dichas fuerzas de atracción se llegan a compensar con la repulsión que los electrones sienten entre sí. En ese punto, la molécula presenta la configuración más estable.
Lo que ha sucedido es que los orbitales de ambos electrones se han solapado, de modo que ahora es imposible distinguir a qué átomo pertenece cada uno de los electrones.
Sin embargo, cuando los átomos son distintos, los electrones compartidos no serán atraídos por igual, de modo que estos tenderán a aproximarse hacia el átomo más electronegativo, es decir, aquel que tenga una mayor apetencia de electrones. Este fenómeno se denomina polaridad (los átomos con mayor electronegatividad obtienen una polaridad más negativa, atrayendo los electrones compartidos hacia su núcleo), y resulta en un desplazamiento de las cargas dentro de la molécula.
Se podría decir que al átomo más electronegativo no le gusta mucho compartir sus electrones con los demás átomos, y en el caso más extremo, deseará que el electrón le sea cedido sin condiciones formándose entonces un enlace iónico, de ahí que se diga que los enlaces covalentes polares tienen, en alguna medida, carácter iónico.
Cuando la diferencia de electronegatividades es nula (dos átomos iguales), el enlace formado será covalente puro ; para una diferencia de electronegatividades de 1,7 el carácter iónico alcanza ya el 35%, y para una diferencia de 3, será del 49.5%.
Así pues, para diferencias de electronegatividades mayores de 3 el enlace será predominantemente de carácter iónico, como sucede entre el oxígeno o flúor con los elementos de los grupos 1 y 2; sin embargo, cuando está entre 0 y 1,7 será el carácter covalente el que predomine, como es el caso del enlace C-H. No obstante, según el químico Raymond Chang, esta diferencia de electronegatividad entre los átomos debe ser 2,0 o mayor para que el enlace sea considerado iónico (Chang, 371).(bibliografía abajo)
Dependiendo de la diferencia de electronegatividad, el enlace covalente puede ser clasificado en covalente polar y covalente puro o apolar. Si la diferencia de electronegatividad está entre 0,4 y 1,7 es un enlace covalente polar, y si es inferior a 0,4 es covalente apolar.
Enlace covalente polar
Cuando un mismo átomo aporta el par electrónico, el enlace covalente es llamado enlace covalente polar. Aunque las propiedades de enlace covalente coordinado son parecidas a las de un enlace covalente normal (dado que todos los electrones son iguales, sin importar su origen), la distinción es útil para hacer un seguimiento de los electrones de valencia y asignar cargas formales. Una base dispone de un par electrónico para compartir y un ácido acepta compartir el par electrónico para formar un enlace covalente coordinado.
Se produce en elementos iguales, es decir, con una misma electronegatividad por lo que su resultado es 0. Un átomo no completa la regla del octeto.
Características del enlace covalente
- Enlace sencillo: 2 electrones unidos físicamente por los subniveles inferiores métricos
- Enlace doble: se comparten dos pares de electrones.
- Enlace triple: se comparten 3 pares de electrones.
- Formado el enlace covalente coordinado es idéntico a los demás enlaces covalentes.
- Se representa con una flecha →
- Enlace cuádruple: es la unión de 4 ó más electrones.
Tipo de enlaces y reactividad de una sustancia
Todo forma parte de los enlaces químicos y expresan los siguientes datos h2o+h03=h202o3. En los enlaces sigma pueden ocurrir las siguientes reacciones (reacciones químicas):
- Sustitución, donde un átomo es sustituido por otro. Lo reemplaza.
- Eliminación, donde un átomo se elimina de la molécula. Generalmente en esta reacción se forma un enlace pi.
Sobre los enlaces pi ocurre la adición, donde se agregan por lo general dos átomos y se forman dos enlaces sigma. En el ejemplo se muestra la adición de un sólo átomo:
- Los enlaces sigma no polares de un átomo saturado son muy poco reactivos y para fines prácticos podemos considerarlos inertes.
- Los enlaces sigma no polares que entran a un átomo insaturado son algo más reactivos, por el efecto del enlace pi.
- Los enlaces sigma polares son reactivos.
- Los enlaces pi son reactivos.
Otro tipo de reacción es la transposición, donde se redistribuyen los átomos existentes para formar un isómero de la substancia original. Esta puede ocurrir en cualquier molécula sin importar el tipo de enlace y el número de enlaces que cambian de lugar, siempre es par.






2 comentarios:
Publicar un comentario